今天推送的文章是发表在ACS Catalysis 上的“RhlA Exhibits Dual Thioesterase and Acyltransferase Activities during Rhamnolipid Biosynthesis”。通讯作者是来自中国科学院深圳先进技术研究院的司同研究员和张建志助理研究员。
正文
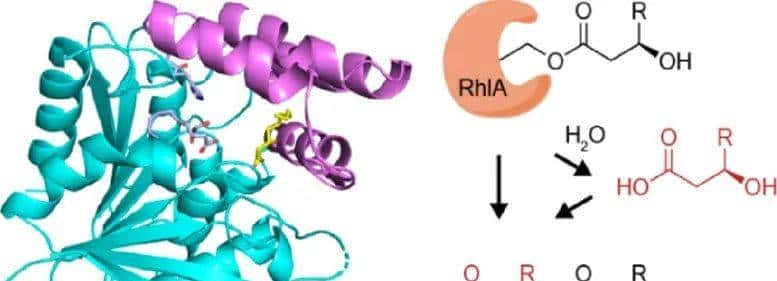
鼠李糖脂(RLs)是一类被广泛研究的生物表面活性剂,由于它们具有优于化学表面活性剂的性能,在提高石油采收率、生物修复、农业和医学方面具有潜在的应用前景。在自然界中发现了60多种RL的同系物和同源物,这些RL含有不同分子结构的亲疏水基团。含有一个或两个亲水性L鼠李糖基团的RLs分别被称为单鼠李糖脂(mono-RLs)和双鼠李糖脂。RLs的疏水部分3-羟基烷酰基-3-羟基烷酸(HAA)是两种不同链长和不饱和程度的活化3-羟基脂肪酸的酯化产物。HAA的生物合成由鼠李糖基转移酶1链A (RhlA)催化,RhlA作为“分子标尺”选择特定的酰基底物。由于不同的脂肪基团赋予相应的RL分子不同的物理化学性质和生物活性,因此超级需要调节RhlA酶的特异性来合成具有特定分子结构的设计RL。
不过,用RhlA进行蛋白质工程是困难的。没有实验解析的RhlA结构的报道。基于同源性建模的结构导向理性工程未能改变RhlA的特异性,这可能是由于结构模板蛋白与RhlA之间的序列同源性较低(<30%)。此外,酶促羟基脂肪酸酯化是一种罕见的反应,缺乏对RhlA催化机理的详细了解。例如,3-羟基脂肪酸底物的酰基载体仍有争议。体外实验表明,酰基载体蛋白(ACP)连接的羟基脂肪酸是纯化的RhlA的底物,即使在高浓度下也不利用CoA连接的底物。相比之下,对天然RL产生菌绿脓杆菌(Pseudomonas aeruginosa)的体内同位素实验研究表明,β-氧化途径中CoA连接的羟基脂肪酸也被纳入HAA和RL产品中。
此外,很少有高通量筛选(HTS)方法可以分辨和量化不同的RL产物,这阻碍了定向进化的实践。此前,作者开发了光引导基质辅助激光解吸/电离飞行时间(MALDI-ToF)质谱(MS)来快速分析含有单RL生物合成途径的重组大肠杆菌菌落的RL产物。作为概念的证明,几个RhlA突变体被成功地从容易出错的PCR文库中鉴定出修改的特异性。在此,作者旨在通过结构阐明和生化表征来阐明RhlA的催化机制和设计规则来指导蛋白质工程。
第一,作者在2.1 Å分辨率下解析了RhlA的X射线晶体结构,全长包含295个氨基酸残基,在不对称单元中观察到一个单一的RhlA单体。除了Gln73和Arg74缺乏电子密度且不可见外,所有其他残基都可以在最终模型中建立(图1A−C)。RhlA的整体结构为典型的α/β水解酶折叠核心结构域,由8个延伸的β-折叠组成,其两侧有α-螺旋,并具有悬垂的帽结构域(图1B)。β1折叠和β3 -β8折叠彼此平行,与β2折叠反平行。从β1和β8链观察到90°旋转,其中β2 – β7折叠以逆时针方向排列。帽结构域位于核心结构域的β6折叠和螺旋αD之间,由四个螺旋组成,即αE(如图1A所示;残基133 ~ 147),αF(残基151 ~ 160),αG(残基168 ~ 179),αH(残基187 ~ 201),以及这些螺旋之间的一些无规卷曲。
基于先前的研究和对RhlA同源物的序列比对,提出了Ser102、His251和Asp223残基构成亲核/组氨酸/酸性三联体,常见于α/β-水解酶超家族成员。由不对称氢键网络协调(图1A,B),这些残基不暴露在表面,而是位于RhlA晶体结构的核心和帽结构域之间。特别是组氨酸残基与酸性残基之间的AspOδ1- HisNδ2距离为2.8 Å。丝氨酸残基的羟基与组氨酸咪唑环的相互作用较弱,SerOγ- HisNε2的长距离(3.4 Å)表明,在原生态构型下,His/Asp电荷接力系统的亲核活化并不有利。
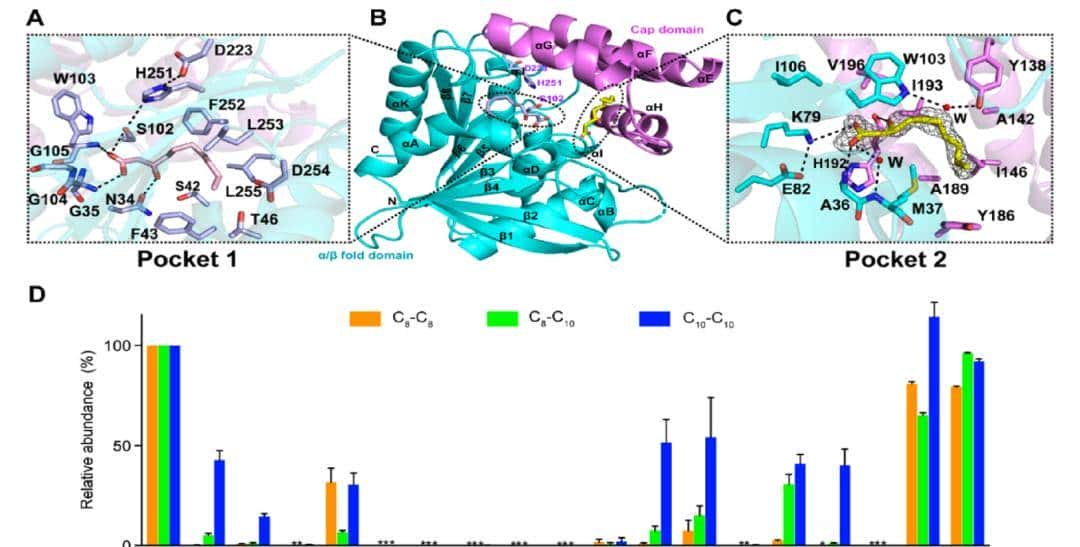
图1
接下来,作者寻求获得配体结合的RhlA晶体来研究底物识别机制。作者用不同长度的外消旋3-OH-Cx-ACP底物对RhlA进行了晶体筛选。但并没有获得RhlA和酰基-ACP的共晶。相反,对于获得的蛋白质晶体,电子密度明确地描绘了3S-OH-C10 酸在RhlARhlA中的配体结合。
值得注意的是,天然HAA和RL产物中3-羟基的立体化学结构为R构型。作者推测,RhlA对s型底物的活性差可能导致RhlA与3S-OH-C10酸的复合物失活,然后在反应过程中积累并形成共晶。为了探索3-羟基脂肪酸配体的立体化学是否对其与RhlA的结合方式产生实质性影响,在AutoDock 4.0中使用lamarkian遗传算法(LGA)对无配体的RhlA结构和3R-OH-C10酸配体进行了分子对接。将口袋1指定为靠近催化活性位点的典型配体结合口袋(图1)。另一个得分最高的姿势将3R-OH-C10酸停靠在帽域下的另一个疏水口袋中(表明为口袋2),该对接姿势与含有3R-OH-C10酸的共晶结构之间的配体构象类似(RMSD为1.5 Å)。作者进一步研究了共晶结构以研究口袋2(图1C)。
3S-OH-C10酸获得L形构象,并通过直接和水介导的氢键网络以及疏水界面与口袋2相互作用(图1C)。在酸配体5 Å半径范围内的关键残基包括Ala36、Met37、Glu82、Val101、Trp103、Tyr138、Ile193和Val196。3S-OH-C10酸的末端羧基与Ala36的主链酰胺氮原子和一个水分子(图1C中指定为W)形成氢键稳定,水分子与Met37的主链酰胺氮原子形成氢键。3S-OH-C10酸的羟基也与His192的羰基氧原子形成氢键。此外,酰基配体与Lys79 NH1和His192的咪唑基团形成两个盐桥,键距分别为3.5和4.95 Å。Glu82的羧酸盐与His192的初始咪唑阳离子之间形成的水介导氢键可能对稳定脂肪酸配体的羧酸盐形式起重大作用。尽管口袋2靠近活性位点,但亲核试剂/组氨酸/酸之间没有直接接触。
鉴于未能获得酰基-ACP结合的RhlA共晶体,作者创建了计算模型来研究酶-配体的相互作用。第一在口袋1中检测了上述含有3R-OH-C10酸的模拟配合物,它由Asn34、Ser42、Phe43、Gly104、Gly105、Phe252、Leu253和Leu255等残基组成,距离对接配体的半径为5 Å(图1A)。酸配体主要通过氢键和疏水相互作用来稳定(图1A)。氢键网络由Gly35、Trp103和Gly104的主链酰胺以及Ser42的羟基形成,而疏水相互作用由Ala38、Phe43、Phe252、Leu253和Leu255介导。此外,在模拟的复合物结构中,在RhlA活性位点附近发现了一个三叉形的氧阴离子空穴,该空穴是由Gly35、Gly104和Ala38的肽性NH基团形成的。柔性甘氨酸残基Gly105可以增加氧阴离子空穴的构象自由度。
为了验证在实验求解和计算模拟的RhlA结构中鉴定的关键残基,作者设计了带有丙氨酸取代的突变体,并使用LC – MS/MS在多反应监测(MRM)模式下检测了由此产生的大肠杆菌菌株的体内HAA产量。野生型(WT)表达RhlA的菌株产生了三个主要的HAA分子,通过MRM离子强度标准校准曲线计算出它们的相对丰度顺序为:C10−C10(52.6%) > C8−C8(26.7%) ~ C8−C10(20.62%)。正如预期的那样,在催化三联体残基Ser102、Asp223和His251上的丙氨酸取代完全消除了HAA的产生(图1D)。当用丙氨酸替换口袋1和口袋2中的选择残基时,大多数突变体积累的HAA比WT少得多, C8−C8和 C8−C10的减少一般比C10-C10的减少更明显(图1D)。特别是,口袋1残基Ser42、Gly104、Gly105和口袋2残基Lys79、His192、Phe252几乎不产生HAA,而口袋1残基Aln34、Gly35、Phe43、Leu253、Leu 255和口袋2残基Glu82、Trp103产生的HAA比WT少50%。另一方面,口袋2的Ile193Ala和Gln195Ala突变对HAA产生的影响不大。综上所述,在模拟和共晶结构中发现的与口袋1和口袋2中酰基底物相互作用的大多数关键残基对RhlA的活性至关重大。
RhlA的硫酯酶和酰基转移酶活性。作者进行了体外生化实验进一步研究了RhlA的催化机制。在体外实验产生的RhlA晶体中游离3S-OH-C10 配体的存在令人困惑,这表明RhlARhlA表现出酰基ACP硫酯酶活性。当5.0 mM 3R-OH-Cx-ACP底物(x = 8,10,12)与1.5μg纯化的RhlA孵育时,在LC-MS/MS痕量中观察到体外游离脂肪酸的产生,除了相应的HAAs(图2A)。为了排除酰基-ACP底物制备过程中残留游离脂肪酸的可能性,在同位素标记的H218O水中用5.0 mM 3R-OH-C10-ACP进行了RhlA测定。从缔合离子的质量从187.0 Da到189.1 Da或190.8 Da的变化(图2B,左)来看,3R-OH-C10酸中吸收了多达两个18O原子,这可能是水解和羧基氧交换反应的结果。再加上对RhlA-脂肪酸共晶的观察,这些结果证实了RhlA具有一种以前未知的硫酯酶活性,这种活性作用于酰基ACPs产生游离3-羟基脂肪酸。
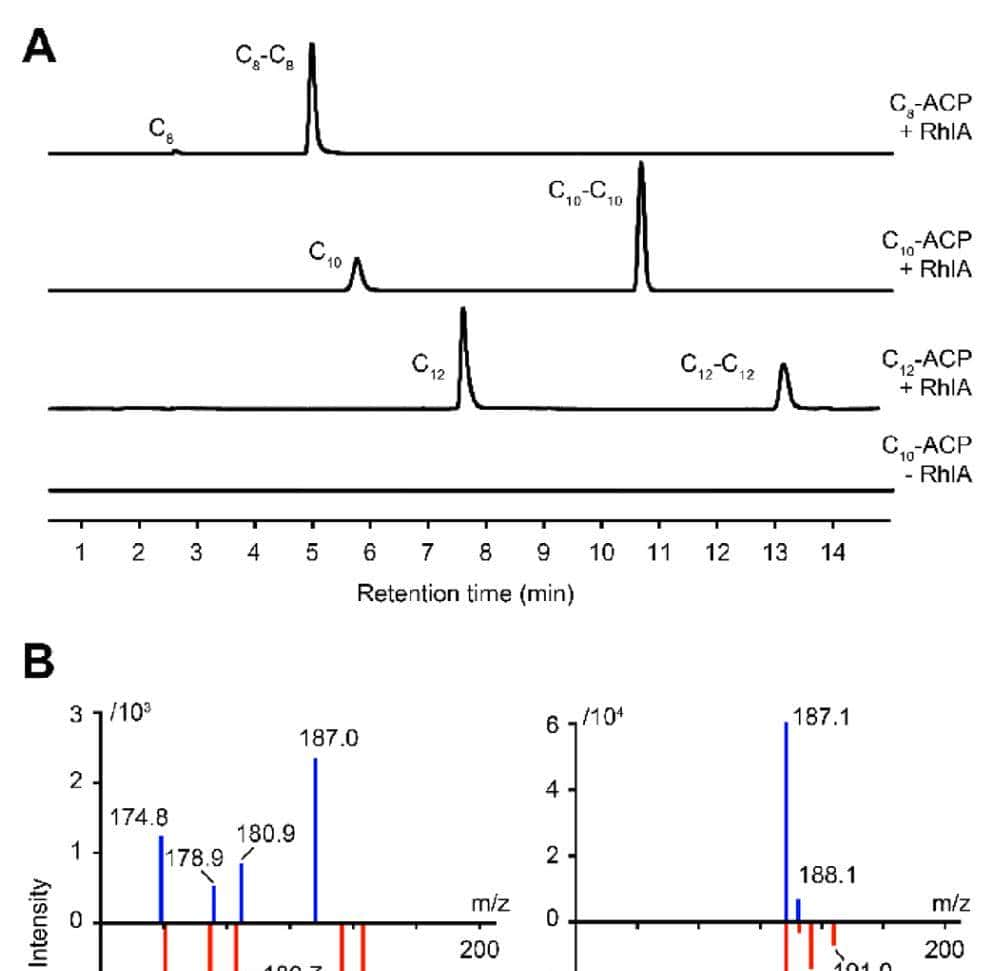
图2
有趣的是,在H2O18 存在下产生的CC10−C HAA10 含有未标记的和18O标记的酰基部分,从对应的串联质谱中m/z值为187.1,189.1和191.0的子离子可以看出(图2B;右)。这一观察结果提出了纯化的RhlA可以利用游离和ACP结合形式的3-羟基脂肪酸作为底物的可能性,其中18O标记的酰基部分来源于RhlA的硫酯酶活性产生的游离脂肪酸,未标记的酰基部分来源于酰基-ACP。通过将游离酸和酰基ACP底物与1.5μg RhlA共喂实验来验证这一假设(图3)。在3.20 mM C8– ACP和3.20 mM C10-ACP底物存在的情况下,C8−C10 和CC10−C10HAAs是主要产物(图3A)。当提供6.65 mM 3R-OH-C8 酸和3.20 mM 3R-OH-C3.20 mM 3R-OH-C-ACP10 时,观察到CC10−C10 和CC8−C10 HAA的产生(图3A)。同样,当施加6.65 mM 3R-OH-C10 酸和3.20 mM 3R-OH-C3.20 mM 3R-OH-C-ACP8 时,RhlARhlA催化形成C8−C8和C8-C HAA(10 图3A)3A),但没有生成C10– HAA(10 图3A)3A)。当省略RhlA时,未检测到C8-ACP和C-acid10 自发形成C8-C8和C8-C HAAs10 和C8C8酸(图3A)。另一方面,与C8-ACP /C10-ACP组合相比,酰基底物混合形式的C8-C10HAAs的生成水平大幅降低了约80%(图3A),表明外源供应的游离脂肪酸是RhlA的不良底物。这些结果证实,RhlA不仅可以从纯ACP结合的底物合成HAA,也可以从共供的游离羟基脂肪酸和酰基ACP合成HAA,尽管后者的反应途径比前者效率低得多。
基于体外生化分析,作者提出了一种RhlA反应途径,包括游离酸和酰基ACP底物,遵循α/β-水解酶的经典机制(图3B),而水和3-羟基脂肪酸的羟基对四面体中间体的亲核攻击分别产生脂肪酸和HAA产物。作者进行了QM/MM计算,以检验所提出的涉及游离3-羟基脂肪酸作为中间体的机制的可行性。QM/MM模拟表明,所提出的途径在热力学上是可行的但该结果不能排除其他可能的RhlA反应途径,即在没有游离3-羟基脂肪酸参与的情况下,由酰基-ACP底物合成HAAs(图3B)。
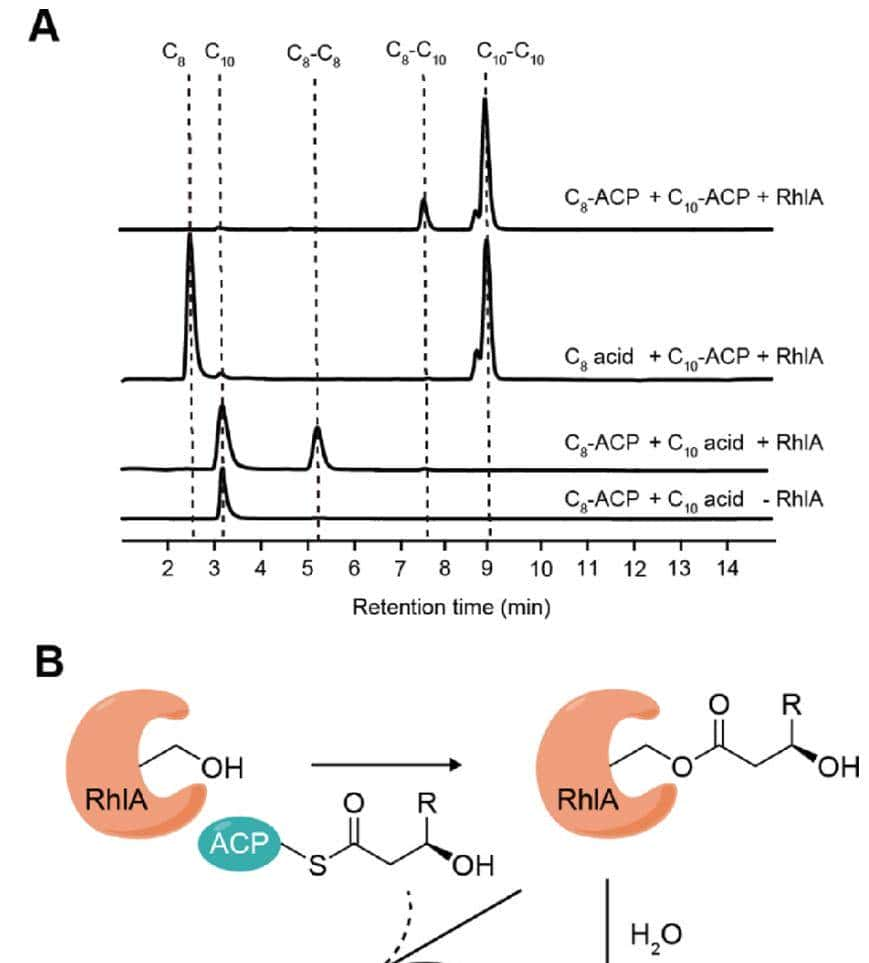
图3
最后,采用半理性性设计来调节RhlA的特异性。基于计算建模的结构,选择了13个位于两个对接配体5 Å半径距离内的残基(图1)进行位点饱和突变(SSM),包括6个位于口袋1的残基(Ser42、Phe43、Ala101、Met125、Leu253和Asp254)和7个位于口袋2的残基(Met37、Ala142、Ile146、Ile154、Tyr186、Ala189和Ile193)。总共有9个RhlA突变被证实使Rha-(C8-C10)的产生比WT增加了2倍以上,包括口袋1中的Ser42Met、Phe43Gln、Phe43Trp、Phe43His、Ala101Met和Leu253Val以及口袋2中的Met37Phe、Met37Cys和Ala142Val(图4A)。对于含有Met37Phe和Ala101Met的前两个突变体,主要的mono-RL产物从Rha-C10−C10转变为Rha- (C8-C)(10 图4B)4B),这是之前通过工程P. aeruginosaRhlA尚未实现的。
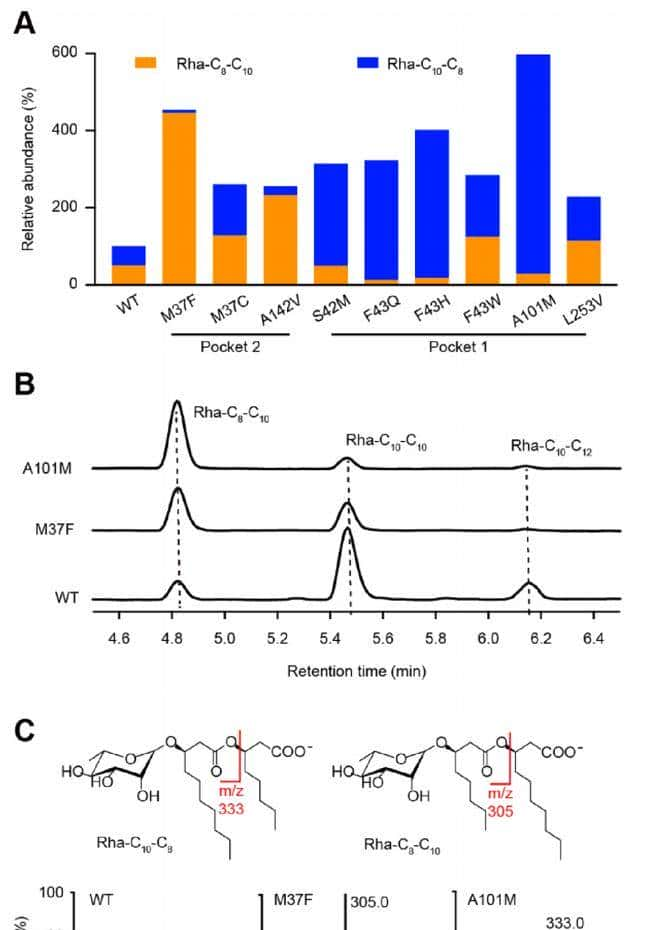
图4
通过检查示踪的离子断裂模式,作者注意到不同配体结合袋的突变倾向于以不同的方式改变酰基链构型。特别是,表达WT RhlA和RhlB酶的大肠杆菌产生了大约等量的Rha-C8-C10和Rha-C10-C8(图4A,C)。除了Met37Cys和Leu253Val突变与WT相比没有改变Rha-C10-C8和Rha-C8-C10 的相对比例外,口袋11突变倾向于Rha-C10-C8 的产生,而口袋22突变则倾向于Rha-C8-C10的产生(图4A)。这些结果表明,预测的残基是RhlA对不同酰基链长度的底物特异性的关键决定因素。更有趣的是,位于不同配体结合口袋中的残基对HAA分子的两个酰基链具有不同的调节作用。
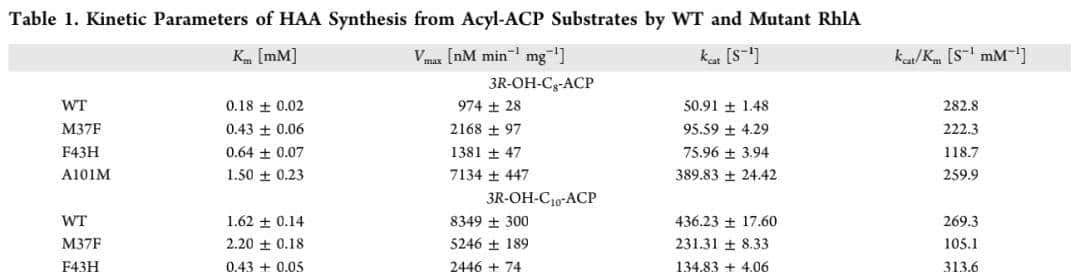
作者使用单个C-ACP8 或CC10-ACP底物测量纯化的RhlA蛋白的表观稳态动力学参数。作者采用Michaelis-Menten方程作为近似描述从酰基-ACP作为单一底物合成HAA的反应动力学(表1)。WT RhlA对两种ACP底物表现出类似的kcat/Km值,尽管C-ACP8 的Km和kcat值比C10-ACP的Km和kcat值小~ 10倍。此外,当检测WT和突变体RhlA的Km、kcat和kcat/Km值时,唯一显示与体内Rha-(C8-C10)产生密切相关的参数(图4)是C8-ACP的kcat值,与WT相比,Met37Phe、Phe43His和Ala101Met突变体分别表现出1.9倍、1.5倍和7.6倍的改善(表1)。这些观察结果表明,催化活性,而不是结合亲和力,是决定RhlA对不同ACP底物的体内链长偏好的主要因素。对于游离脂肪酸的合成,WT、Met37Phe和Ala101Met RhlA生产C8-酸的数据图很好地符合Michaelis-Menten,这是对使用酰基-ACP作为单一底物的RhlA硫酯酶活性的预期。
作者对铜绿假单胞菌RhlA进行了结构和生化表征。在首次报道的RhlA X-射线晶体结构中意外存在3-羟基脂肪酸配体的启发下,研究了3-羟基脂肪酸作为反应中间体的参与,揭示了RhlA作为硫酯酶和酰基转移酶的双重活性。不过,所提出的反应途径在体外HAA合成中起次要作用,需要进一步研究RhlA的替代催化机制。此外,在RhlA中发现了两个配体结合口袋,并通过结构引导诱变鉴定了突变;这些位于不同口袋的突变对调节HAAs的两个酰基链长度具有相反的作用。另一方面,作者未能获得RhlA和酰基ACPs的共晶,而蛋白质-蛋白质对接模拟具有很高的不确定性。因此,需要进一步阐明RhlA-ACP-酰基络合物的结构。总之,揭示的生物合成机制可能有助于RhlA(半)理性设计的蛋白质工程合成设计RL产品。

相关文章